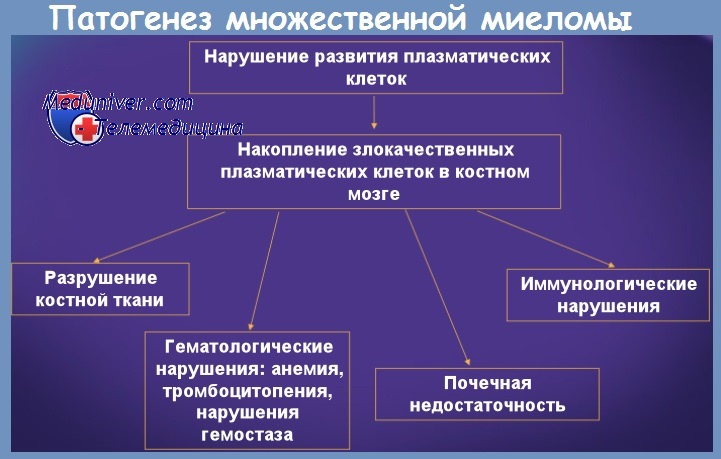
Клиническая и биологическая картина множественной миеломы определена с одной стороны туморальной пролиферацией миеломатозных клеток, а с другой стороны секретированием Ig этими клетками.
Исследования, проведенные in vivo и in vitro позволили определить время генерации миеломатозной клетки, а именно — 76—96 часов. Срок удвоения туморальной массы составляет, согласно некоторым авторам, 3 месяца (Drewinko и Alexanian), а согласно другим — приблизительно 6 месяца (Hobbs). Повидимому не сцществует разницы в клеточной кинетике между миеломами IgG и IgA.
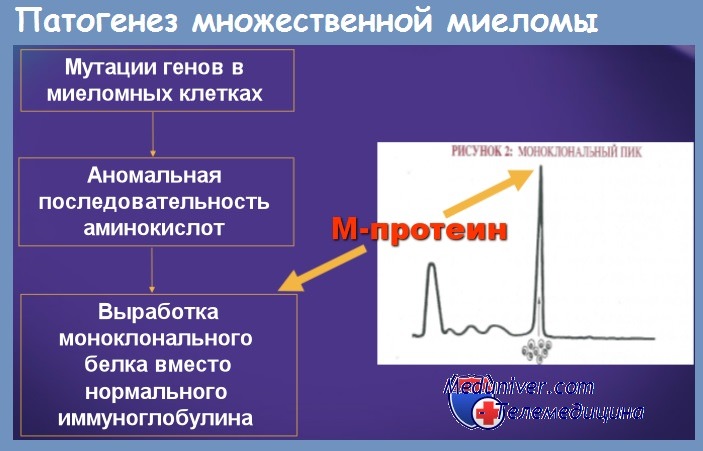
Как указывалось выше, миеломатозные клетки обладают способностью секретировать цельные Ig и/или цепи L особой гомогенности, что подтверждает гипотезу о злокачественной пролиферации одной клетки. Поэтому миелома входит в категорию моноклинальных гаммапатий. Рост миеломатозных Ig в сыворотке ассоциируется с количественным сокращением нормальных Ig вследствие ингибиции деятельности нормальных плазмоцитов (Salmon).
Исследования тканевых культур показали, что коэффициент синтеза миеломатозного Ig составляет в среднем 10—20 пг/клетку/сутки. Крайние количества варьируют между 2,5 и 38 пг/клетку/сутки. В молекулярном выражении, миеломатозная клетка может секретировать между 5200 и 90 000 молекул Ig в минуту (Salmon и Durie). Наиболее высокие коэффициенты синтеза встречались у больных с гипервязкостью сыворотки.
Полужизнь IgG составляет 11,6—17 дней, по сравнению с 20—24 днями у нормальных лиц, причем коэффициент катаболизации в 10 раз больше у больного с миеломой по сравнению с здоровым лицом. При миеломе IgG, коэффициент катаболизации возрастает параллельно с концентрацией Ig в сыворотке, в то время как при миеломе IgA коэффициент катаболизации остается сравнительно постоянным (Strober и сотр.). В зависимости от общего количества Ig и коэффициента секреции на клетку, Salmon и сотр. смогли рассчитать массу туморальных клеток в организме, по следующей формуле:
Общее число миеломатозных клеток = Коэффициент глобального синтеза компонента М / Коэффициент клеточного синтеза компонента М
Эта туморальная масса, в момент диагноза варьирует между 0,20 х 10 12 (приблизительно 200 г) и 1 х 10 12 (приблизительно 1 кг) клеток. Исходя из предпосылки, что время удвоения миеломатозных клеток остается постоянным в течение всей эволюции болезни и что отправной точкой является размножение одной клетки, Salmon и сотр. рассчитали, что заболевание начинается за 15—20 лет до клинического начала, заключение, подобное сделанному Hobbs.
Из этих данных вытекает, что диагноз множественной миеломы определяется поздно и в настоящее время ее невозможно выявить на более ранней стадии. Математические рассчеты показали, что для того, чтобы иметь возможность выявить в сыворотке больного миеломатозный Ig, необходимо располагать минимальным количеством секретирующих клеток равным 5 X 10 10 (около 50 г) клеток; но такое количество туморальных клеток практически невозможно обнаружить.
Туморальный рост миеломатозных клеток приводит к разрушению нормальной костной ткани с локализованными или диффузными лизисами, костными переломами, вертебральными тассированиями и пр. Образование внекостных опухолей может вызывать явления компрессии на смежные органы.
Распространение туморальной массы в костном мозге приводит к замене гематопоэтического клеточного населения с наступлением анемии, лейкопении и/или тромбопении.
Секретирование миеломатозного Ig в циркулирующую кровь влечет за собой возникновение гиперпротеинемии. Эти Ig обладают рядом биологических свойств, которые порождают множество клинических и биологических симптомов. Так, молекулы Ig имеют тенденцию аггрегиророваться между собой, образуя синдром гипервязкости. Аггрегация с сывороточными коагулирующими факторами (фибриноген, протромбин, фактор V и фактор VII) влечет за собой появление модификаций гемостазы, с появлением геморрагических явлений. Миеломатозные Ig имеют тенденцию примыкать к поверхности форменных элементов крови.
Примыкание к гематиям влечет за собой образование изображения монетных столбиков, которые наблюдаются на мазке; примыкание к лейкоцитам снижает способность к фагоцитозу, а примыкание к тромбоцитам ведет к сокращению их функциональной способности с появлением геморрагических явлений. Обострению геморрагических явлений способствует также и отложение Ig в капиллярных стенках, увеличивая их пермеабильность. Миеломатозные протеины и в особенности протеины Бенс-Джонса скопляются в почечнных канальцах, способствуя возникновению почечной недостаточности.
При миеломе часто встречаются отложения амилоидных или параамилоидных веществ. Их скопление в известных паренхимах ведет к возникновению той или иной функциональной недостаточности, особенно почечной. Образование амилоида еще не совсем выяснено; предполагается, что это — последствие перехода молекул Ig в различные ткани, где они могут связываться с полисахаридами, образуя нерастворимые комплексы. Zlotnick и Rosenmann получили in vitro амилоидные волокна путем протеолитической диггестии протеина Бенс-Джонса, явление, которое может происходить и на уровне тканей.
В очень редких случаях миеломатозные Ig обладают способностью преципитировать при температурах около 30°С (криоглобулины), в результате чего появляются явления Рейно и изъязвления конечностей.
На таблице приводим биологические характеристики миеломатозных протеинов и клинические симптомы, которые они генерируют.
Человеческие парапротеины (по Oslerland и Espinoza)
| Биологические свойства | Клинические симптомы |
| Аггрегация | Синдром гипервязкости Нефропатия |
| Аггрегация с факторами коаугляции: фибриноген, фактор V, фактор VII, протромбин | Аномалийные тесты коагуляции, геморрагические явления, нарушения ретракции сгустка |
| Обертывание лейкоцитов и тромбоцитов | Лейкопения, сокращение фагоцитоза; тромбопения, сокращение функции тромбоцитов |
| Обертывание гематий | Образование монетних столбиков, анемия, эритрофагоцитоз |
| Криопреципитация | Синдром Рейно |
Из-за сокращения нормального Ig, благодаря ингибиции синтеза и усилению их катаболизацин, антителовый гуморальный ответ на различные антигенные стимулы (пневмококк, Brucella, Salmonella typhosa, Esch. coli, гематии А и В, гематии овцы) понижен (Fahey и сотр.). Гиперчувствительность позднего типа повидимому не модифицирована у этих больных (Cone и сотр.).
Нарушения гуморального ответа создают у больных с множественной миеломой высокую чувствительность к инфекциям, чувствительность, которая усугубляется и посттерапевтической лейкопенией.
В настоящее время широко обуждается механизм сокращения синтеза нормальных Ig и соответственно сокращение гуморального иммунитета при множественной миеломе. Было выдвинуто несколько патогенетических теорий, в том числе:
— теория халонов, согласно которой плазмоциты высвобождают ряд ингибиторов нормальных лимфоцитов В (халоны);
— теория «иммунологической конверсии» — согласно которой злокачественные плазмоцитарные клетки высвобождают подединицы РНК, которые могут альтерировать деятельность нормальных рецепторов Ig лимфоцитов Б, препятствуя ответу на антигены. Однако по всей вероятности действительность гораздо сложнее, так как лимфоциты В и Т от больных с плазмоцитомами представляют на своей мембране идиотип патологического протеина.
Некоторые авторы считают, что множественная миелома может представлять собой злокачественную пролиферацию штаммовой лимфоидной клетки, а лимфоциты с моноклональными идиотипами, находящиеся в циркуляции, являются повидимому злокачественными лимфоцитами в различных стадиях созревания (Broder и Waldman);
— снижение синтеза нормального Ig у больных с множественной миеломой может быть связано и с наличием супрессорных клеток, существование которых было доказано в клеточных культурах. Эти клетки ингибируют синтез Ig нормальных лимфоцитов и имеют черты макрофагов. В экспериментальной патологии деятельность этих клеток находится в зависимости от активирующего вещества выделяемого туморальными клетками (Katzman).
Множественная миелома
Множественная миелома — это злокачественная опухоль лимфоидной природы, для которой характерна триада признаков:
- Колонизация костного мозга опухолевыми плазматическими клетками.
- Возникновение очагов расплавления костной ткани (деструкция кости).
- Обнаружение в крови и/или моче специфического белка — моноклонального глобулина.
Основу миеломы составляют плазматические клетки (дифференцированные В-лимфоциты, плазмоциты). Они секретируют особый белок — моноклональный иммуноглобулин, он же М-белок, М-компонент, М-протеин, который негативно влияет на организм, приводя к развитию тяжелых симптомов. Кроме того, колонизация плазмоцитами костного мозга приводит к нарушению кроветворения и очаговому расплавлению костной ткани.
- Симптомы множественной миеломы
- Виды множественной миеломы
- Стадии и прогноз при множественной миеломе
- Причины множественной миеломы
- Диагностика множественной миеломы
- Как лечится множественная миелома
- Диета и питание при миеломе
Симптомы множественной миеломы
В начальных стадиях множественная миелома протекает бессимптомно. По мере увеличения количества опухолевых клеток, заболевание прогрессирует и могут развиваться следующие симптомы:
- Боль в костях. Обычно множественная миелома локализуется в плоских костях — это череп, таз, лопатка. Из губчатых костей в основном поражаются позвонки. Злокачественные миеломные клетки провоцируют растворение вокруг себя костной ткани и образованию полостей с ровными краями. Отсюда и основные симптомы — боли и патологические переломы. В начале они носят мигрирующий характер и возникают при смене положения тела. В конце развивается нестерпимый болевой синдром, движения практически невозможны.
- Гиперкальциемия. Резорбция кости клетками миеломы приводит к выходу большого количества кальция в кровь. Из-за этого у пациентов развивается тошнота, рвота, сонливость, оглушенность сознания вплоть до комы.
- Поражение почек, — миеломная нефропатия, является одной из основных причин смерти при данном заболевании. Развивается оно из-за действия М-белка, гиперкальциемии, амилоидоза и инфекционных осложнений. Характеризуется протеинурией (белок в моче) и нарастанием почечной недостаточности. Основным патологическим фактором является склероз почечных канальцев из-за фильтрации большого количества миеломного белка и накопления его легких цепей (белка Бенс-Джонса).
- Синдром гипервязкости крови. Он развивается, когда уровень М-компонента в крови превышает значение 50 г/л. Симптоматически проявляется кровотечениями, нарушением зрения и оглушенностью сознания.
- Поражение костного мозга клетками миеломы приводит к нарушению кроветворения из-за чего развиваются тяжелые анемии, глубокие иммунодефицитные состояния, кровоточивость.
- Амилоидоз — накопление в тканях внутренних органов особых белков. Проявляется поражением почек, сердца, печени, нейропатией.
- Неврологическая симптоматика развивается из-за «проседания» позвонков, что приводит к сдавлению спинномозговых корешков, развитию болевого синдрома, чувства онемения, и даже параличам.

Виды множественной миеломы
Существует несколько классификаций миеломной болезни. По степени распространенности опухолевых поражений выделяют:
- Диффузная форма множественной миеломы. Происходит инфильтрация костного мозга без костных разрушений (остеодеструкции).
- Диффузно-очаговая форма миеломы. Помимо инфильтрации костного мозга имеются очаги деструкции костей.
- Множественно-очаговая форма миеломы. Есть очаги остеодеструкции, но нет диффузного поражения костного мозга. В этом случае при исследовании пунктата возможно получение нормальной миелограммы.
- Редкие формы миеломы — склеротическая, висцеральная и др.
Также множественная миелома классифицируется на основе иммунохимического типа опухоли. Основным фактором здесь является вид патологического иммуноглобулина, определяемого в крови и моче. Выделяют G, A, D, E, M-миелому, миелому Бенс-джонса, биклональную и несекретирующую.
Стадии и прогноз при множественной миеломе
Стадирование множественной миеломы определяется на основании 4-х параметров: количество М-компонента, уровень гемоглобина, уровень кальция, степень поражения костей. Стадии:
- 1 стадия миеломы – легкая анемия (гемоглобин более 100 г/л), кальций в норме, низкий М-белок, менее 5 очагов поражения костей. Средняя продолжительность жизни таких пациентов составляет 6,5 лет.
- 2 стадия миеломы – анемия средней степени тяжести, кальций повышен до 3 ммоль/л, количество очагов остеолизиса не превышает 20, уровень М-компонента: 35 IgG
Причины множественной миеломы
Причиной развития миеломной болезни являются мутации в клетках-предшественницах В-лимфоцитов. Что приводит к этим мутациям, до конца неизвестно. Но выделяют несколько факторов риска, при наличии которых вероятность развития заболевания превышает общепопуляционную:
- Возраст старше 40 лет.
- Мужской пол.
- Принадлежность к негроидной расе.
- Наличие моноклональной гаммапатии — у каждого сотого такого пациента развивается миелома.
- Вторичные иммунодефициты — ВИЧ, прием иммуносупрессивной терапии.
- Наличие миеломы среди близких кровных родственников.
- Наличие в анамнезе радиационного воздействия, в том числе лучевой терапии.
Диагностика множественной миеломы
Диагностика миеломы предполагает оценку жалоб пациента и проведение инструментальных методов диагностики:
- Лабораторные исследования — помимо рутинных анализов выполняется биопсия костного мозга и/или опухолевой ткани, определение β2-микроглобулина и др.
- Рентген костей или компьютерная томография костей для поиска очагов остеодеструкции.
- Иммунофенотипирование и цитогенетическое исследование опухолевых клеток для определения прогноза и составления плана лечения.
Диагноз множественной миеломы выставляется на основании следующих критериев:
- Уровень плазмоцитов в костном мозге или опухолевом биоптате превышает 10%.
- В крови и моче определяется М-белок (кроме несекретирующей формы множественной миеломы).
- Присутствуют признаки поражения внутренних органов миеломными клетками — гиперкальциемия, анемия, поражение костей, почечная недостаточность.
Как лечится множественная миелома
Множественная миелома сегодня считается неизлечимым заболеванием. Усилия медицины направлены на то, чтобы сдержать рост опухоли, продлить и улучшить качество жизни таких больных.
После того, как диагноз установлен, необходимо решить вопрос, необходимо ли пациенту специфическое лечение, или можно ограничиться наблюдением, поскольку при «тлеющей миеломе» (нет симптомов, но есть лабораторные изменения) возможна выжидательная тактика.
Выделяют следующие виды лечения миеломы:
- Стандартная химиотерапия. Назначается пациентам, которым противопоказана высокодозная полихимиотерапия. Средняя продолжительность жизни после нее 29 месяцев. В стандартную схему первой линии входит мелфалан и преднизолон. Более эффективные схемы включают талидомид, леналидомид или бортезомиб (относительно новые противоопухолевые препараты).
- Высокодозная полихимиотерапия (ВПХТ) с последующей пересадкой кроветворных стволовых клеток ТГСК (как аутологичных, так и донорских). Данное лечение позволяет достичь полной ремиссии у большинства пациентов (до 75%), но к сожалению, в течение 2-5 лет отмечается прогрессирование заболевания. Более эффективным является проведение двойного курса ВПХТ с ТГСК (тандемная ВПХТ). Она позволяет добиться пятилетней безрецидивной выживаемости у 90% пациентов. Но такое тяжелое лечение могут перенести не все пациенты, поэтому показания к нему ограничены.
- Поддерживающая терапия. Даже ВПХ не может предотвратить развитие рецидива, назначается лечение, которое призвано подавлять клон злокачественных клеток. С этой целью используются интерфероны. Они помогают продлить медиану безрецидивной выживаемости до 42 месяцев.
- Борьба с осложнениями. Лечение боли — назначение сильных аналгезирующих препаратов, лучевая терапия. Хирургические операции проводятся при компрессионных переломах позвонков. Коррекция осложнений, вызванных угнетением кроветворения — переливание эритромассы и назначение эритропоэтина, применение антибиотиков при повышении температуры. Проведение гемодиализа, плазмофереза, назначение бисфосфонатов для контроля гиперкальциемии.

Диета и питание при миеломе
Особой диеты при множественной миеломной болезни не требуется, за исключением периода прохождения химиотерапии. Учитывая то, что основным побочным эффектом такого лечения является потеря аппетита, тошнота и рвота, требуется легкое и, вместе с тем, калорийное сбалансированное питание. Более подробные рекомендации пациенту дает лечащий врач.
Множественная миелома крови: механизм развития, клиническая картина, диагностика и принципы лечения
Клиническая и биологическая картина множественной миеломы определена с одной стороны туморальной пролиферацией миеломатозных клеток, а с другой стороны секретированием Ig этими клетками.
Исследования, проведенные in vivo и in vitro позволили определить время генерации миеломатозной клетки, а именно — 76—96 часов. Срок удвоения туморальной массы составляет, согласно некоторым авторам, 3 месяца (Drewinko и Alexanian), а согласно другим — приблизительно 6 месяца (Hobbs). Повидимому не сцществует разницы в клеточной кинетике между миеломами IgG и IgA.
Как указывалось выше, миеломатозные клетки обладают способностью секретировать цельные Ig и/или цепи L особой гомогенности, что подтверждает гипотезу о злокачественной пролиферации одной клетки. Поэтому миелома входит в категорию моноклинальных гаммапатий. Рост миеломатозных Ig в сыворотке ассоциируется с количественным сокращением нормальных Ig вследствие ингибиции деятельности нормальных плазмоцитов (Salmon).
Исследования тканевых культур показали, что коэффициент синтеза миеломатозного Ig составляет в среднем 10—20 пг/клетку/сутки. Крайние количества варьируют между 2,5 и 38 пг/клетку/сутки. В молекулярном выражении, миеломатозная клетка может секретировать между 5200 и 90 000 молекул Ig в минуту (Salmon и Durie). Наиболее высокие коэффициенты синтеза встречались у больных с гипервязкостью сыворотки.
Полужизнь IgG составляет 11,6—17 дней, по сравнению с 20—24 днями у нормальных лиц, причем коэффициент катаболизации в 10 раз больше у больного с миеломой по сравнению с здоровым лицом. При миеломе IgG, коэффициент катаболизации возрастает параллельно с концентрацией Ig в сыворотке, в то время как при миеломе IgA коэффициент катаболизации остается сравнительно постоянным (Strober и сотр.). В зависимости от общего количества Ig и коэффициента секреции на клетку, Salmon и сотр. смогли рассчитать массу туморальных клеток в организме, по следующей формуле:
Общее число миеломатозных клеток = Коэффициент глобального синтеза компонента М / Коэффициент клеточного синтеза компонента М
Эта туморальная масса, в момент диагноза варьирует между 0,20 х 10 12 (приблизительно 200 г) и 1 х 10 12 (приблизительно 1 кг) клеток. Исходя из предпосылки, что время удвоения миеломатозных клеток остается постоянным в течение всей эволюции болезни и что отправной точкой является размножение одной клетки, Salmon и сотр. рассчитали, что заболевание начинается за 15—20 лет до клинического начала, заключение, подобное сделанному Hobbs.

Из этих данных вытекает, что диагноз множественной миеломы определяется поздно и в настоящее время ее невозможно выявить на более ранней стадии. Математические рассчеты показали, что для того, чтобы иметь возможность выявить в сыворотке больного миеломатозный Ig, необходимо располагать минимальным количеством секретирующих клеток равным 5 X 10 10 (около 50 г) клеток; но такое количество туморальных клеток практически невозможно обнаружить.
Туморальный рост миеломатозных клеток приводит к разрушению нормальной костной ткани с локализованными или диффузными лизисами, костными переломами, вертебральными тассированиями и пр. Образование внекостных опухолей может вызывать явления компрессии на смежные органы.
Распространение туморальной массы в костном мозге приводит к замене гематопоэтического клеточного населения с наступлением анемии, лейкопении и/или тромбопении.
Секретирование миеломатозного Ig в циркулирующую кровь влечет за собой возникновение гиперпротеинемии. Эти Ig обладают рядом биологических свойств, которые порождают множество клинических и биологических симптомов. Так, молекулы Ig имеют тенденцию аггрегиророваться между собой, образуя синдром гипервязкости. Аггрегация с сывороточными коагулирующими факторами (фибриноген, протромбин, фактор V и фактор VII) влечет за собой появление модификаций гемостазы, с появлением геморрагических явлений. Миеломатозные Ig имеют тенденцию примыкать к поверхности форменных элементов крови.
Примыкание к гематиям влечет за собой образование изображения монетных столбиков, которые наблюдаются на мазке; примыкание к лейкоцитам снижает способность к фагоцитозу, а примыкание к тромбоцитам ведет к сокращению их функциональной способности с появлением геморрагических явлений. Обострению геморрагических явлений способствует также и отложение Ig в капиллярных стенках, увеличивая их пермеабильность. Миеломатозные протеины и в особенности протеины Бенс-Джонса скопляются в почечнных канальцах, способствуя возникновению почечной недостаточности.
При миеломе часто встречаются отложения амилоидных или параамилоидных веществ. Их скопление в известных паренхимах ведет к возникновению той или иной функциональной недостаточности, особенно почечной. Образование амилоида еще не совсем выяснено; предполагается, что это — последствие перехода молекул Ig в различные ткани, где они могут связываться с полисахаридами, образуя нерастворимые комплексы. Zlotnick и Rosenmann получили in vitro амилоидные волокна путем протеолитической диггестии протеина Бенс-Джонса, явление, которое может происходить и на уровне тканей.

В очень редких случаях миеломатозные Ig обладают способностью преципитировать при температурах около 30°С (криоглобулины), в результате чего появляются явления Рейно и изъязвления конечностей.
На таблице приводим биологические характеристики миеломатозных протеинов и клинические симптомы, которые они генерируют.
Человеческие парапротеины (по Oslerland и Espinoza)
| Биологические свойства | Клинические симптомы |
| Аггрегация | Синдром гипервязкости Нефропатия |
| Аггрегация с факторами коаугляции: фибриноген, фактор V, фактор VII, протромбин | Аномалийные тесты коагуляции, геморрагические явления, нарушения ретракции сгустка |
| Обертывание лейкоцитов и тромбоцитов | Лейкопения, сокращение фагоцитоза; тромбопения, сокращение функции тромбоцитов |
| Обертывание гематий | Образование монетних столбиков, анемия, эритрофагоцитоз |
| Криопреципитация | Синдром Рейно |
Из-за сокращения нормального Ig, благодаря ингибиции синтеза и усилению их катаболизацин, антителовый гуморальный ответ на различные антигенные стимулы (пневмококк, Brucella, Salmonella typhosa, Esch. coli, гематии А и В, гематии овцы) понижен (Fahey и сотр.). Гиперчувствительность позднего типа повидимому не модифицирована у этих больных (Cone и сотр.).
Нарушения гуморального ответа создают у больных с множественной миеломой высокую чувствительность к инфекциям, чувствительность, которая усугубляется и посттерапевтической лейкопенией.
В настоящее время широко обуждается механизм сокращения синтеза нормальных Ig и соответственно сокращение гуморального иммунитета при множественной миеломе. Было выдвинуто несколько патогенетических теорий, в том числе:
— теория халонов, согласно которой плазмоциты высвобождают ряд ингибиторов нормальных лимфоцитов В (халоны);
— теория «иммунологической конверсии» — согласно которой злокачественные плазмоцитарные клетки высвобождают подединицы РНК, которые могут альтерировать деятельность нормальных рецепторов Ig лимфоцитов Б, препятствуя ответу на антигены. Однако по всей вероятности действительность гораздо сложнее, так как лимфоциты В и Т от больных с плазмоцитомами представляют на своей мембране идиотип патологического протеина.
Некоторые авторы считают, что множественная миелома может представлять собой злокачественную пролиферацию штаммовой лимфоидной клетки, а лимфоциты с моноклональными идиотипами, находящиеся в циркуляции, являются повидимому злокачественными лимфоцитами в различных стадиях созревания (Broder и Waldman);
— снижение синтеза нормального Ig у больных с множественной миеломой может быть связано и с наличием супрессорных клеток, существование которых было доказано в клеточных культурах. Эти клетки ингибируют синтез Ig нормальных лимфоцитов и имеют черты макрофагов. В экспериментальной патологии деятельность этих клеток находится в зависимости от активирующего вещества выделяемого туморальными клетками (Katzman).
Миеломная болезнь
Миеломная болезнь – злокачественная пролиферация зрелых дифференцированных плазматических клеток, сопровождающаяся усиленной выработкой моноклональных иммуноглобулинов, инфильтрацией костного мозга, остеолизом и иммунодефицитом. Миеломная болезнь протекает с болями в костях, спонтанными переломами, развитием амилоидоза, полинейропатии, нефропатии и ХПН, геморрагического диатеза. Диагноз миеломной болезни подтверждается данными рентгенографии скелета, комплексного лабораторного исследования, биопсии костного мозга и трепанобиопсии. При миеломной болезни проводится моно- или полихимиотерапия, лучевая терапия, аутотрансплантация костного мозга, удаление плазмоцитомы, симптоматическое и паллиативное лечение.


- Классификация миеломной болезни
- Причины и патогенез миеломной болезни
- Симптомы миеломной болезни
- Диагностика миеломной болезни
- Лечение и прогноз миеломной болезни
- Цены на лечение
Общие сведения
Миеломная болезнь (болезнь Рустицкого-Калера, плазмоцитома, множественная миелома) – заболевание из группы хронических миелобластных лейкозов с поражением лимфоплазмоцитарного ряда гемопоэза, приводящее к накоплению в крови аномальных однотипных иммуноглобулинов, нарушению гуморального иммунитета и разрушению костной ткани. Миеломная болезнь характеризуется низким пролиферативным потенциалом опухолевых клеток, поражающих преимущественно костный мозг и кости, реже — лимфоузлы и лимфоидную ткань кишечника, селезенку, почки и другие органы.
На миеломную болезнь приходится до 10 % случаев гемобластозов. Заболеваемость миеломной болезнью составляет в среднем 2-4 случая на 100 тыс. населения и увеличивается с возрастом. Болеют, как правило, пациенты старше 40 лет, дети – в крайне редких случаях. Миеломной болезни более подвержены представители негроидной расы и лица мужского пола.
Классификация миеломной болезни
По типу и распространенности опухолевого инфильтрата выделяют локальную узловую форму (солитарную плазмоцитому) и генерализованную (множественную миелому). Плазмоцитома чаще имеет костную, реже — внекостную (экстрамедуллярную) локализацию. Костная плазмоцитома проявляется одиночным очагом остеолиза без плазмоклеточной инфильтрации костного мозга; мягкотканная – опухолевым поражением лимфоидной ткани.
Множественная миелома встречается чаще, поражает красный костный мозг плоских костей, позвоночника и проксимальных отделов длинных трубчатых костей. Подразделяется на множественно-узловатую, диффузно-узловатую и диффузную формы. С учетом характеристик миеломных клеток выделяют плазмоцитарную, плазмобластную, и низкодифференцированные (полиморфно-клеточную и мелкоклеточную) миелому. Миеломные клетки избыточно секретируют иммуноглобулины одного класса, их легкие и тяжелые цепи (парапротеины). В связи с этим различают иммунохимические варианты миеломной болезни: G-, A-, M-, D-, E- миеломы, миелому Бенс-Джонса, несекретирующую миелому.
В зависимости от клинических и лабораторных признаков определяют 3 стадии миеломной болезни: I – с малой массой опухоли, II – со средней массой опухоли, III – с большой массой опухоли.
Причины и патогенез миеломной болезни
Причины миеломной болезни не выяснены. Довольно часто определяются разнотипные хромосомные аберрации. Имеет место наследственная предрасположенность к развитию миеломной болезни. Подъем заболеваемости связан с влиянием радиоактивного облучения, химических и физических канцерогенов. Миеломная болезнь часто выявляется у людей, имеющих контакт с нефтепродуктами, а также у кожевенников, столяров, фермеров.
Перерождение клеток лимфоидного ростка в миелому начинается в процессе дифференцировки зрелых B-лимфоцитов на уровне проплазмоцитов и сопровождается стимуляцией определенного их клона. Ростовым фактором миеломных клеток служит интерлейкин-6. При миеломной болезни обнаруживаются плазмоциты различной степени зрелости с чертами атипизма, отличающиеся от нормальных большим размером (>40 мкм), бледной окраской, многоядерностью (нередко 3-5 ядер) и наличием нуклеол, бесконтрольным делением и длительным сроком жизни.
Разрастание миеломной ткани в костном мозге приводит к деструкции кроветворной ткани, угнетению нормальных ростков лимфо- и миелопоэза. В крови снижается количество эритроцитов, лейкоцитов и тромбоцитов. Миеломные клетки не способны полноценно выполнять иммунную функцию из-за резкого снижения синтеза и быстрого разрушения нормальных антител. Факторы опухоли дезактивируют нейтрофилы, снижают уровень лизоцима, нарушают функции комплемента.
Локальная деструкция костей связана с замещением нормальной костной ткани пролиферирующими миеломными клетками и стимуляцией остеокластов цитокинами. Вокруг опухоли формируются очаги растворения костной ткани (остеолиза) без зон остеогенеза. Кости размягчаются, становятся ломкими, значительное количество кальция выходит в кровь. Парапротеины, поступая в кровяное русло, частично депонируются в различных органах (сердце, легких, ЖКТ, дерме, вокруг суставов) в виде амилоида.
Симптомы миеломной болезни
Миеломная болезнь в доклиническом периоде протекает без жалоб на плохое самочувствие и может обнаружиться лишь при лабораторном исследовании крови. Симптомы миеломной болезни обусловлены плазмоцитозом костей, остеопорозом и остеолизом, иммунопатией, нарушением функции почек, изменением качественных и реологических характеристик крови.
Обычно множественная миелома начинает проявляться болями в ребрах, грудине, позвоночнике, ключицах, плечевых, тазовых и бедренных костях, самопроизвольно возникающими при движениях и пальпации. Возможны спонтанные переломы, компрессионные переломы грудного и поясничного отделов позвоночника, приводящие к укорочению роста, сдавлению спинного мозга, что сопровождается радикулярной болью, нарушением чувствительности и моторики кишечника, мочевого пузыря, параплегией.

Миеломный амилоидоз проявляется поражением различных органов (сердца, почек, языка, ЖКТ), роговицы глаза, суставов, дермы и сопровождается тахикардией, сердечной и почечной недостаточностью, макроглоссией, диспепсией, дистрофией роговицы, деформацией суставов, кожными инфильтратами, полинейропатией. Гиперкальциемия развивается при тяжелом течении или терминальной стадии миеломной болезни и сопровождается полиурией, тошнотой и рвотой, дегидратацией, мышечной слабостью, вялостью, сонливостью, психотическими расстройствами, иногда — комой.
Частым проявлением заболевания является миеломная нефропатия с устойчивой протеинурией, цилиндрурией. Почечная недостаточность может быть связана с развитием нефрокальциноза, а также с AL-амилоидозом, гиперурикемией, частыми инфекциями мочевых путей, гиперпродукцией белка Бенс-Джонса, приводящего к повреждению почечных канальцев. При миеломной болезни может развиться синдром Фанкони — почечный ацидоз с нарушением концентрирования и подкисления мочи, потерей глюкозы и аминокислот.
Миеломная болезнь сопровождается анемией, снижением продукции эритропоэтина. За счет выраженной парапротеинемии происходит значительный рост СОЭ (до 60-80 мм/ч), увеличение вязкости крови, нарушение микроциркуляции. При миеломной болезни развивается иммунодефицитное состояние, повышается восприимчивость к бактериальным инфекциям. Уже в начальном периоде это приводит к развитию пневмонии, пиелонефрита, имеющих в 75% случаев тяжелое течение. Инфекционные осложнения являются одними из ведущих прямых причин летальности при миеломной болезни.
Синдром гипокогуляции при миеломной болезни характеризуется геморрагическим диатезом в виде капиллярных кровоизлияний (пурпуры) и синяков, кровотечений из слизистых десен, носа, пищеварительного тракта и матки. Солитарная плазмоцитома возникает в более раннем возрасте, имеет медленное развитие, редко сопровождается поражением костного мозга, скелета, почек, парапротеинемией, анемией и гиперкальциемией.
Диагностика миеломной болезни
При подозрении на миеломную болезнь проводится тщательный физикальный осмотр, пальпацией болезненных участков костей и мягких тканей, рентгенография грудной клетки и скелета, лабораторные исследования, аспирационная биопсия костного мозга с миелограммой, трепанобиопсию. Дополнительно в крови определяют уровни креатинина, электролитов, C-реактивного белка, b2-микроглобулина, ЛДГ, ИЛ-6, индекса пролиферации плазмоцитов. Проводится цитогенетическое исследование плазматических клеток, иммунофенотипирование мононуклеарных клеток крови.
При множественной миеломе отмечается гиперкальциемия, увеличение креатинина, снижение Hb 1%.. При плазмоцитозе >30% в отсутствии симптомов и костной деструкции (или ее ограниченном характере) говорят о вялотекущей форме заболевания.
Главными диагностическими критериями миеломной болезни служат атипическая плазматизация костного мозга >10-30%; гистологические признаки плазмоцитомы в трепанате; присутствие плазматических клеток в крови, парапротеина в моче и сыворотке; признаки остеолиза либо генерализованного остеопороза. Рентгенография грудной клетки, черепа и таза подтверждает наличие локальных участков разрежения костной ткани в плоских костях.
Важным этапом является дифференциация миеломной болезни с доброкачественной моноклональной гаммапатией неопределенного генеза, макроглобулинемией Вальденстрема, хронической лимфолейкемией, неходжкинской лимфомой, первичным амилоидозом, костными метастазами рака толстой кишки, легких, остеодистрофией и др.

Лечение и прогноз миеломной болезни
Лечение миеломной болезни начинают сразу после верификации диагноза, что позволяет продлить жизнь больного и повысить ее качество. При вялотекущей форме возможна выжидательная тактика с динамическим наблюдением до нарастания клинических проявлений. Специфическая терапия миеломной болезни проводится при поражении органов-мишеней (т. н. CRAB — гиперкальциемии, почечная недостаточности, анемии, костной деструкции).
Основной метод лечения множественной миеломы – длительная моно- или полихимиотерапия с назначением алкилирующих препаратов в сочетании с глюкокортикоидами. Полихимиотерапия чаще показана при II, III стадиях заболевания, I стадии протеинемии Бенс-Джонса, прогрессировании клинической симптоматики.
После лечения миеломной болезни рецидивы проявляются в течение года, каждая последующая ремиссия менее достижима и короче предыдущей. Для удлинения ремиссии обычно назначаются поддерживающие курсы препаратов a-интерферона. Полная ремиссия достигается не более чем в 10% случаев.
У молодых пациентов в первый год выявления миеломной болезни после курса высокодозированной химиотерапии проводится аутотрансплантации костного мозга или стволовых клеток крови. При солитарной плазмоцитоме применяется лучевая терапия, обеспечивающая многолетнюю ремиссию, при неэффективности назначается химиотерапия, хирургическое удаление опухоли.
Симптоматическое лечение миеломной болезни сводится к коррекции электролитных нарушений, качественных и реологических показателей крови, проведению гемостатического и ортопедического лечения. Паллиативное лечение может включать болеутоляющие средства, пульс-терапию глюкокортикоидами, лучевую терапию, профилактику инфекционных осложнений.
Прогноз миеломной болезни определяется стадией заболевания, возрастом больного, лабораторными показателями, степенью почечной недостаточности и костных поражений, сроками начала лечения. Солитарная плазмоцитома часто рецидивирует с трансформацией во множественную миелому. Самый неблагоприятный прогноз при III Б стадии миеломной болезни — со средней продолжительностью жизни 15 месяцев. При III А стадии она составляет 30 месяцев, при II и I А, Б стадии — 4,5-5 лет. При первичной резистентности к химиотерапии выживаемость составляет менее 1 года.
Множественная миелома. Этиология, патогенез, классификация, клиника, диагностика, дифференциальная диагностика, лечение.
Миеломная болезнь- Это злокачественное опухолевое заболевание из группы парапротеинемических гемобластозов : разрастание плазматических клеток с инфильтрацией костного мозга, разрушением костной ткани и подавлением нормального кроветворения. Миеломная болезнь — это самый частый из гемобластозов , при которых происходит трансформация плазматических клеток.
Этиология: Причины заболевания неизвестны. Злокачественная трансформация при миеломной болезни, по-видимому, происходит на этапах дифференцировки В-лимфоцитов , предшествующих плазматическим клеткам.
Патогенез:
1) Гиперкальциемия, патологические переломы, сдавление спинного мозга, остеолитические очаги, остеопороз, боль в костях- Разрушение костей- Рост опухоли и выработка ее клетками факторов активации остеокластов
2) Почечная недостаточность- Экскреция с мочой легких цепей, гиперкальциемия, уратная нефропатия, AL-амилоидоз (редко)- Токсическое действие парапротеинов, легких цепей, факторов активации остеокластов, продуктов распада ДНК
3) Пиелонефрит- Гипогаммаглобулинемия
4) Анемия- Миелофтиз, сниженная продукция эритроцитов, гемолиз- Рост опухоли и выработка ее клетками тормозных факторов и аутоантител
5) Инфекции- Гипогаммаглобулинемия, замедленная миграция нейтрофилов- Сниженный синтез и ускоренный распад IgG
6) Неврологическая симптоматика- Повышенная вязкость крови, криоглобулинемия, AL-амилоидоз- Гиперпротеинемия, свойства парапротеина, секреция легких цепей
7) Гиперкальциемия, сдавление спинного мозга- Действие факторов активации остеокластов
8) Кровоточивость- Коагулопатия, повреждение эндотелия амилоидом, тромбоцитопатия- Взаимодействие парапротеина с факторами свертывания, антитела к факторам свертывания, секреция легких цепей, опсонизация тромбоцитов антителами
9) Объемные образования- Рост опухоли
Клиника: К клиническим проявлениям миеломной болезни относятся в первую очередь поражения костей, бактериальные инфекции, поражения почек, анемии.
1) поражение костей— боли в костях . Обычно они локализуются в ребрах и позвоночнике. В отличие от болей при метастазах солидных опухолей, которые усиливаются по ночам , при миеломной болезни боли провоцируются движениями . Постоянная локализованная боль при миеломной болезни обычно связана с патологическим переломом . Остеолиз ведет к поступлению в кровь значительного количества кальция, поэтому в клинической картине могут преобладать острые и хронические осложнения гиперкальциемии .
2) бактериальные инфекции— Наиболее часты пневмония (возбудителями обычно служат Streptococcus pneumoniae , Staphylococcus aureus и Klebsiella pneumoniae ) и пиелонефрит ( Escherichia coli и другие грамотрицательные бактерии ). Склонность к инфекциям связана с несколькими причинами. Прежде всего, у всех больных имеется гипогаммаглобулинемия (если не считать парапротеин ). Она обусловлена как пониженной продукцией антител, так и их ускоренным разрушением. Кроме того, у некоторых больных в ответ на опухоль появляются регуляторные клетки, подавляющие синтез нормальных антител.
3) поражение почек— развивается почечная недостаточность. Чаще всего она обусловлена гиперкальциемией ; другими причинами служат AL-амилоидоз , гиперурикемия , частые инфекции , редко — опухолевая инфильтрация почек. Первым проявлением повреждения канальцев служит синдром Фанкони — почечный проксимальноканальцевый ацидоз , сопровождающийся потерей глюкозы, аминокислот и нарушением способности почек подкислять и концентрировать мочу.
Протеинурия не сопровождается артериальной гипертонией; практически весь белок представлен легкими цепями. Так как клубочки обычно не страдают, уровень альбумина в моче невысок. При повреждении клубочков протеинурия становится неселективной.
4) анемия- нормоцитарной нормохромной анемией . Она связана с вытеснением костного мозга опухолевыми клетками и угнетением кроветворения факторами, секретируемыми опухолью.
Возможен также легкий гемолиз . Чаще обычного встречается мегалобластная анемия вследствие дефицита витамина В12 или дефицита фолиевой кислоты . Нейтропения и тромбоцитопения крайне редки. Взаимодействие парапротеина с тромбоцитами , фактором V , фактором VII , фактором VIII , протромбином и фибриногеном может нарушать гемостаз .
5) неврологическая симптоматика— Гиперкальциемия вызывает слабость , депрессию , сонливость , спутанность сознания . Синдром повышенной вязкости крови проявляется головной болью , утомляемостью , нарушениями зрения , ретинопатией . При компрессионных переломах позвонков могут возникать корешковые боли , сдавление спинного мозга , задержка мочи , недержание мочи , запор или недержание кала . Сдавление нервов отложениями амилоида приводит к развитию синдрома запястного канала , сенсорно-моторным мононейропатиям и полинейропатиям .
Лечение. Подавляющему большинству больных требуется лечение. Оно складывается из химиотерапии, направленной на подавление роста опухоли, и симптоматического лечения, нацеленного на профилактику осложнений.
При II и III стадиях заболевания, а также при I стадии с экскрецией легких цепей, прогрессирующим остеолизом , компрессионными переломами позвонков, частыми инфекциями или нарастающим М-градиентом в сыворотке показана полихимиотерапия. Лечение позволяет продлить жизнь больным и улучшить ее качество.
Обычно проводят 4-7-дневные курсы химиотерапии алкилирующим средством ( мелфаланом , 8 мг/м2/сут внутрь, циклофосфамидом , 200 мг/м2/сут в/в, или хлорамбуцилом , 8 мг/м2/сут внутрь) в сочетании с преднизоном (25-60 мг/м2/сут внутрь). Алкилирующие средства примерно равны по силе; резистентность к ним часто носит перекрестный характер. Наиболее популярен мелфалан.
На молодых больных испытывается высокодозная химиотерапия с последующей трансплантацией стволовых клеток крови .
Большинство врачей проводят курсы химиотерапии каждые 4-6 нед в течение 1-2 лет. После прекращения терапии наступает рецидив, обычно в течение года. После возобновления лечения второй ремиссии достигают 80% больных.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).


Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.












